| Ler mensagens sem resposta | Pesquisar por tópicos ativos |
Bem-vindo: 15.01.2026(Qui)7:04 |
|
Todos os horários são GMT - 3 horas |
|
|
Página 1 de 3 |
[ 27 mensagens ] | Ir para página 1, 2, 3 Próximo |
| Exibir página para impressão | Exibir tópico anterior | Exibir próximo tópico |
Cultura de sementes e tecidos de PC, c/referências na Web
| Autor | Mensagem |
|---|---|
|
Registrado em: 16.01.2009(Sex)22:12 Mensagens: 221 Localização: Curitiba (PR) |
Work in progress!
 As mensagens estão sendo editadas para criar uma curta (e modesta) revisão sobre cultura de tecidos. Obs: não sou experiente em matéria, só estou lendo sobre o assunto e criando este guia para me orientar e, se possível, ajudar os outros membros do fórum. A CULTURA IN VITRO DE SEMENTES E TECIDOS VEGETAIS, em três palavras A cultura in vitro permite crescer sementes e tecidos vegetais em condições de abundância de nutrientes - não somente nitrogênio, potássio e fósforo, mas também com grandes quantidades de fontes imediatas de energia, geralmente açucar (sacarose). Para evitar que o sacarose promova o crescimento de bactérias e mofos, a cultura deve ser realizada em condições estéreis e controladas -ou seja, in vitro. As vantagens da cultura in vitro podem ser resumidas em produzir: -rapidamente -grandes quantidades -de plantas idénticas às originais. Nem sempre o cultivador é interessado às três vantagens: quem cultiva de sementes certamente quer que as plántulas se desenvolvam rapidamente, mas não está criando plantas geneticamente idénticas - aliás, pode estar torçendo para que algumas delas tenham características novas e valiosas. Se quiserem dar uma olhada, >este blog< mostra a incrível velocidade de crescimento de um explante de Dionaea "cupped trap" e de seedlings de várias espécies de plantas carnívoras. O cultivo celular é geralmente realizado em três etapas -a primeira é o estabelecimento, a partir de sementes ou tecidos não estéreis, do cultivo em meio rico de nutrientes, sem contaminação por nenhum microorganismo; -a segunda é o crescimento e a propagação das plantas; -a terceira é a preparação das plantas para a transferência para substrato ou terreno "normal". A ESTERILIDADE Por causa da grande quantidade de açúcar no meio de cultivo, a técnica só pode ser realizada em condções de total ausência de microorganismos. Caso contrário, o meio de cultivo seria tomado pelos microorganismos em poucos dias (bactérias) ou poucas semanas (fungos/mofos), com perda da planta (ver de novo o >blog<). Isto indica a necessidade de: -uma metódica de esterilização de meios, instrumentação, frascos de cultivo, etc.; -uma metódica de esterilização das sementes e tecidos; -uma área estéril para manuseio dos tecidos após esterilização e das plantas em cultivo. Estas necessidades são atendidas com facilidade em laboratórios de pesquisa, no caso da esterilização, por meio de >autoclaves< e no caso da área estéril, por meio de >capelas de fluxo laminar<. Em casa, devemos utilizar recursos mais simples. O autoclave é basicamente uma grande panela de pressão, que atinge pressões controladas de até 130-140C. A esterilização é feita em 121C por 20 minutos, ou 131C por 15 minutos. Nas panelas de pressão comuns, a pressão atingida é geralmente menor, cerca de 110-115C. Assim é possível usá-las para esterilizar instrumentação, meio de cultivo e frascos, mas o tempo de esterilização deverá ser maior (30-35 minutos). CUIDADO! É fundamental lembrar que qualquer tipo de recipiente não poderá ser colocado fechado na panela de pressão: por um lado, a fechadura ão permite ao vapor entrar no recipiente para esterilizá-lo, e por outro lado, existe risco de explosão (ou implosão) durante ou depois a esterilização. Os recipientes devem ser colocados parcialmente abertos, e deverão ser fechados logo após a abertura da panela para preservar a esterilidade. Outra possibilidade é o uso de forno microondas, mas eu não aconselho: a chance de contaminação vai ser maior, e também a chance de fazer melecas com o meio e cultivo. A capela de fluxo laminar é uma mesa para trabalho estéril, em cima da qual é continuamente jogado ar estéril. Assim, qualquer recipiente aberto em baixo do fluxo de ar estéril não será contaminado por microorganismos. Embora existam sugetões para construir capelas de fluxo laminar caseiras (>aqui<), o sistema mais comum para se trabalhar em casa em condições decentes (nunca vai ser estéril de verdade, mas tem boas chances de não contaminar os frascos) é utilisar uma estrutura em plástico, fechada, e borrifá-la com hipoclorito (e borrifar tudo que seja introduzido embaixo dela, inclusive as luvas do operador) para eliminar miroorganismos. Para que isto der certo, é importante trabalhar num quarto limpo, em ausência de qualquer movimentação de ar (janelas abertas, pessoas caminhando). Para exemplos, ver >este vídeo< ou estes sites (1) (2). Sobre esterilização de sementes e tecidos, a opção mais simples é o uso de álcool/H2O2/hipoclorito. Outras opções são o NaDCC (dicloroisocianurato de sódio, ou dicloro-s-triazinatriona de sódio) e o PPT (5-cloro-2-metil-4-isotiazolin-3-ona + 2-metil-4-isotiazolin-3-ona). Falarei mais sobre isto na parte técnica do guia.  _________________ A red Dionaea is a state of mind. Editado pela última vez por RobertoR em 03.01.2010(Dom)15:09, em um total de 26 vezes. |
| 21.12.2009(Seg)21:57 |
|
|
Registrado em: 19.10.2008(Dom)14:50 Mensagens: 510 |
Experimento de alto porte hahahahhaha
Boa sorte com ele... _________________ EDUARDO <<<<< http://www.naturalchemist.com/?ref=zemeczak |
| 21.12.2009(Seg)22:27 |
|
|
Destaque Registrado em: 03.11.2009(Ter)9:29 Mensagens: 646 Localização: Belo Horizonte |
interessante a ideia, temos que tentar fazer de tudo com as nossas plantas...
espero que dê certo |
| 22.12.2009(Ter)10:29 |
|
|
Registrado em: 16.01.2009(Sex)22:12 Mensagens: 221 Localização: Curitiba (PR) |
Do fórum:
Confiram este tópico muito bom, do Marcos Ono, sobre cultura de tecidos Link repassado de outro tópico - Noções de Cultivo de Tecidos Vegetais (EMBRAPA), em português Sites interessantes sobre cultura de tecidos "caseira": (PT = português, EN = inglês) Vídeos no YouTube sobre cultura de tecido caseira, inclusive de sementes de Nepenthes [EN] Germinacão in vitro de orquídeas [PT] Blog com descrição e fotos de cultivo de Dionaea in vitro Boa e breve introdução à cultura de tecidos na UFRPE [PT] Outra introdução, no EMBRAPA [PT] Plant tissue culture techniques - com muitos desenhos explicativos [EN] Apresentação de PowerPoint sobre CT, com muitas fotos [EN] Ótimo site, com receita para meio caseiro [EN] Cultura de tecidos de PC no worldofcarnivores.com, bem feito [EN] Cultura de tecidos de violetas, com fotos [EN] Vários documentos sobre cultura de tecidos [EN] Uso do NaDCC: (1)[PDF], (2), (3) [EN] "Tissue culture at home" [EN] Alguns pequenos protocolos no site da Sigma-Aldrich [EN] (na verdade, não muitos) Aclimatização das plantas [PDF] [EN] Livros sobre cultura de tecidos, com visualização completa no Google Books: Experiments in plant tissue culture (1985) - É um livro muito bem escrito, simples, com dados históricos e muitos detalhes experimentais. É de 1985 mas vale MUITO a pena ler. Plant tissue culture techniques no ableweb.org - Legal, muitos gráficos explicativos. Ornamental plant propagation in the tropics (2000) - Uma introdução geral bem interessante, e fichas técnicas detalhadas sobre o cultivo de inúmeras plantas ornamentais. Tissue Culture: Management of in Vitro Plantlets in Potato Seed Production (1998) - Manual bem técnico, com desenhos explicativos. Mesmo sendo focado em CT de batatas, é interessante. Shoot-tip culture for the propagation, conservation and distribution of Musa germplasm (1998) - De particular interesse os capítulos 4 (técnicas, com detalhameto das fases) e 9 (possíveis problemas). Minimum requirements for receiving and maintaining tissue culture propagation material (FAO, 1985) - Graficamente a edição é horrível, mas o manual é curtinho e interessante. Quem já leu os livros acima não vai encontrar conceitos novos. Auxílios Partes da planta em inglês Indicador de pH feito com suco de repolho roxo (1) (2) Esterilização Construindo uma capela de fluxo laminar _________________ A red Dionaea is a state of mind. Editado pela última vez por RobertoR em 06.01.2010(Qua)16:07, em um total de 50 vezes. |
| 23.12.2009(Qua)9:40 |
|
|
Registrado em: 07.09.2009(Seg)17:26 Mensagens: 246 Localização: Fortaleza/Ce |
Boa sorte Roberto! depois posta aqui os resultados.
Abraço! _________________ http://www.flickr.com/marcel_lucena Growlist&Wishlist Fotos Minhas PC´s |
| 23.12.2009(Qua)9:49 |
|
|
Registrado em: 16.01.2009(Sex)22:12 Mensagens: 221 Localização: Curitiba (PR) |
Obrigado Marcel!!
Me toquei que "deveria" fazer um teste com o NaDCC para verificar a concentração certa, antes de testar nas plantas... uff...!!! Vamos lá! _________________ A red Dionaea is a state of mind. |
| 23.12.2009(Qua)10:04 |
|
|
Destaque
Registrado em: 02.07.2009(Qui)14:17 Mensagens: 221 Localização: Goiânia - Goiás - Brasil |
Roberto,
interessante post. Ficará bem legal. Mas tenho algumas duvidas e perguntas a você. Depois de inoculada, como você manterá a cultura? Pelo que li e visitei uma laboratorio aqui, se mantem em sala aclimatizada, com temperatura regulada, e principalmente lampadas especiais pra crescimento e manutançao. Você está montando uma sala de crescimento e propagaçao em casa? Como você fará essa etapa em casa? Abração |
| 23.12.2009(Qua)15:44 |
|
|
Registrado em: 16.01.2009(Sex)22:12 Mensagens: 221 Localização: Curitiba (PR) |
Olá Fabrício! Sim, é verdade. Eu não pretendo fazer isto - vou deixar os frascos de cultivo ao abrigo da luz solar direta, num local bem iluminado, dentro de uma caixa de isopor aberta. Não tendo incubadora com fotoperíodo, não tenho opção. Além disto, menos insumos de laboratório estarei usando, mais fácil será para outros membros do fórum fazer a mesma coisa. Este é o primeiro teste; depois, vamos ver se consigo eliminar mais tecnologia...
Abraços! Roberto _________________ A red Dionaea is a state of mind. |
| 23.12.2009(Qua)16:16 |
|
|
Registrado em: 16.01.2009(Sex)22:12 Mensagens: 221 Localização: Curitiba (PR) |
Ok! Primeiro teste heheh.
(É que se não faço alguma coisa divertida enquanto trabalho no Natal, fico doido). PRIMEIRO TESTE, 23/12/2009 Ingredientes do meio de cultivo: -Fertilizante para bonsai Vitaplan (escolhi o fertilizante para bonsai por ter macro e microelementos; 8% de nitrogénio) -Smartcaps energy (as vitaminas mais baratas que encontrei, com guaraná heheh) -Metiocolin B12 drágeas (para inositol) -sacarose, agar, água. Como o M&S tem cerca de 0,08% de nitrogênio (0,85 g/l), e é usado diluido 1:2, usarei o fertilizante 1:200 p/p (5g/l) ou 2,5g / 500 ml. [nossa, parece muito!?!] Pelo Smartcaps, vou me basear na tiamina e colocar uma cápsula por 500 ml (2,4 mg/l) (Obs. o Francisco Eduardo postou um tópico indicando o remédio Benerva como fonte de tiamina) Metiocolin B12: 1 drágea em 500 ml (inositol: 100 mg/l). Para esterilizar as sementes, usarei parte de um comprimido de NaDCC (dicloroisocianurato de sódio, ou dicloro-s-triazinatriona de sódio) para disinfecção de equipamentos de água ultrapura (Elga Labwater). Vou testar também o clássico hipoclorito de sódio, vamos ver se funciona O NaDCC é vendido também como disinfectante para piscinas sob o nome de "Dicloro" (ou "Dicloro 60%", que apesar do "60%" é na verdade dicloroisocianurato puro). Obs. existem pastilhas de "Tricloro" (es. GenClor da HTH), mas é outra substância (tricloroisocianurato ou Tricloro-S-triazina triona) e pode ser mais tóxica, não sei. Composição do meio de cultivo: Código: Fert. p/bonsai Vitaplan (farelado) (2,5g/500ml) Nitrogênio 8% 0,04% (Murashige & Skoog: 0,08%) Fósforo 9% 0,045% Potássio 9% 0,045% Cálcio 3% 0,015% Enxofre 2% 0,01% Magnésio 1% 0,005% Boro 0,03% 0,00015% Cobalto 0,005% 0,000025% Cobre 0,2% 0,001% Ferro 0,2% 0,001% Molibdênio 0,005% 0,000025% Zinco 0,35% 0,00175% Metiocolin B12 (mg/cp) (1cp em 500ml) Inositol 50 100mg/L (aconselhada: 100 mg/L) Racemetionina 100 200mg/L Cloreto de colina 25 50mg/L Cianocobalamina (B12) 0,002 0,004mg/L (*) Smartcaps (mg/cp) (mg/L em 500ml) Tiamina (B1) 1,2 2,4mg/L (aconselhada: 0,1-10 mg/L) Riboflavina (B2) 1,3 2,6mg/L Niacina (B3) 14 28mg/L Ácido Pantoténico (B5) 5 10mg/L Piridoxina (B6) 1,3 2,6mg/L Cianocobalamina (B12) 0,0024 0,0048mg/L (*) (total: 0,0088mg/L) Ácido Ascórbico (C) 17 34mg/L Ajustar o pH: 6 (com hidróxido de sódio) (aconselhado: pH 5,4-5,8) Sacarose 20g/L (aconselhado: 3-20 g/L) Ágar 10g/L (aconselhado: 6-10 g/L) NaDCC: 1 tablete (CT1 Sanitization Tablets, Elga Labwater), 2,3g = 10% em 23 ml de água MEIO DE CULTIVO: PARA 500 ML Em 400 ml de água quente (para dissolver melhor o fertilizante), colocar: 2,5g fertilizante para Bonsai Vitaplan (triturar muito bem antes de colocar na água) 1 drágea de Metiocolin B12 (amassar bem antes de colocar na água)  Agitar para dissolver o máximo que der Esfriar Ajustar o pH: inesperadamente é ácido, pH 3,5. Ajustado com NaOH 5M até pH 6. Agua até 500 ml Adicionar: 1 cápsula de Smartcaps Energy (eu cortei ao meio, mas dá para deixar inteira, a gelatina dissolve bem) 10g de sacarose 5g de agar 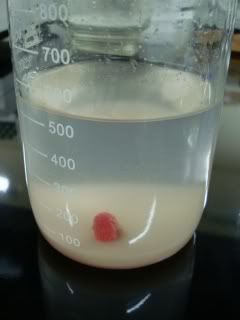 Autoclavar, 120°C 20min. (autoclavar também água para depois). (Algumas vitaminas não vão resistir ao calor. Azar.)  Deixar esfriar um pouco, agitar bem, dispensar 80 ml nos frascos sem NaDCC Adicionar NaDCC (1:1000, 0,01%), agitar bem, versar nos frascos Sementes: 1) esterilizadas em NaDCC 0,5% + 0,2% detergente (Tween-20), 30', e enxaguadas em água estéril (ou não); ou 2) passadas em etanol 70%, esterilizadas em hipoclorito 0,1%, e enxaguadas em água estéril.  ...e boa noite, durmam bem ;)  Pela próxima vez tentarei fazer tudo mais "caseiro", juro - e quem quiser tentar também, sinta-se a vontade ;) Vamos formar o Núcleo Bugiganga de Cultura de Tecidos, NBCT! Quem diria que são uma pessoa séria, hein (Fernando Rivadavia, não olhe, não olhe que estou com vergonha!!!) _________________ A red Dionaea is a state of mind. Editado pela última vez por RobertoR em 02.01.2010(Sáb)18:22, em um total de 6 vezes. |
| 23.12.2009(Qua)17:13 |
|
|
Registrado em: 16.01.2009(Sex)22:12 Mensagens: 221 Localização: Curitiba (PR) |
Fabrício, duas coisas me preocupam neste meu teste: a primeira, como você notou, é que uma intensidade de luz insuficiente vai diminuir a quantidade de O2 no frasco se for fechado, e deixar o frasco semiaberto vai acabar secando o meio no final; a segunda é que, mesmo o NaDCC sendo interessante pela possibilidade de adicioná-lo ao meio e preservá-lo de contaminações, ele produz cloro, e todos sabem quanto as PC odeiam cloro...
Vamos ver; sobre a luz, acho que vou começar pensando em evitar o meio secar, mais do que aumentar a luz... por enquanto heheheh! Sobre o NaDCC e o cloro, se as PCs não aguentarem, irei procurar o famoso "PPM" ou tavéz tentar alguma solução caseira. (MacGyver, oras para mim!) _________________ A red Dionaea is a state of mind. Editado pela última vez por RobertoR em 30.12.2009(Qua)9:41, em um total de 1 vez. |
| 24.12.2009(Qui)17:17 |
|
|
|
Página 1 de 3 |
[ 27 mensagens ] | Ir para página 1, 2, 3 Próximo |
|
Todos os horários são GMT - 3 horas |
Quem está online |
Usuários navegando neste fórum: Nenhum usuário registrado e 8 visitantes |
| Enviar mensagens: Proibido Responder mensagens: Proibido Editar mensagens: Proibido Excluir mensagens: Proibido |
